أنظمة إدارة التجارب السريرية (CTMS)
الميزات، وخطوات التطوير، والتكاليف
تستفيد ساينس سوفت من خبرتها الممتدة في مجال تقنية معلومات الرعاية الصحية منذ عام 2005، لتطوير برمجيات متقدمة لإدارة التجارب السريرية بكفاءة.
لمحة عامة على برمجيات إدارة التجارب السريرية
تُعد أنظمة إدارة التجارب السريرية (CTMS) من الركائز الأساسية لإدارة بيانات التجارب السريرية بكفاءة، بما في ذلك بروتوكول الدراسة، واستقطاب المرضى وتسجيلهم، وإعداد الميزانية، ومتابعة تقدم الدراسة، والالتزام بالامتثال التنظيمي، وغيرها من الجوانب ذات الصلة.
تُقدم أنظمة CTMS المخصصة ميزات متقدمة لتلبية احتياجات مجالات طبية محددة، مثل التنبؤ بالأحداث القلبية في دراسات أمراض القلب، والحساب الآلي لمنحنيات كابلان-ماير (Kaplan-Meier) في مجال طب الأورام. كما تتمتع هذه الأنظمة بإمكانات متقدمة للتكامل وقابلية التوسع، ما يجعلها خيارًا مثاليًا للمؤسسات التي تدير تجارب سريرية معقدة ومتنوعة.
- عمليات التكامل الأساسية: مع أنظمة السجلات الطبية أو الصحية الإلكترونية (EHR/EMR)، وأنظمة معلومات المستشفى (HIS)، وأنظمة معلومات الأشعة (RIS)، وأنظمة معلومات المختبر (LIS)، وبرمجيات تخطيط موارد المؤسسات (ERP)، وأنظمة الدفع، وأنظمة الباركود، وأنظمة مراقبة المرضى عن بُعد (RPM).
- المدة الزمنية للتنفيذ: من 6 أشهر إلى أكثر من 18 شهرًا.
- تكاليف التطوير: من 187,000 ريال سعودي إلى أكثر من 1.8 مليون ريال سعودي.
للحصول على تقدير مخصص لتكلفة مشروعكم، يمكنكم استخدام أداة حساب التكلفة المجانية لدينا.
نموذج للبنية التقنية لأنظمة إدارة التجارب السريرية
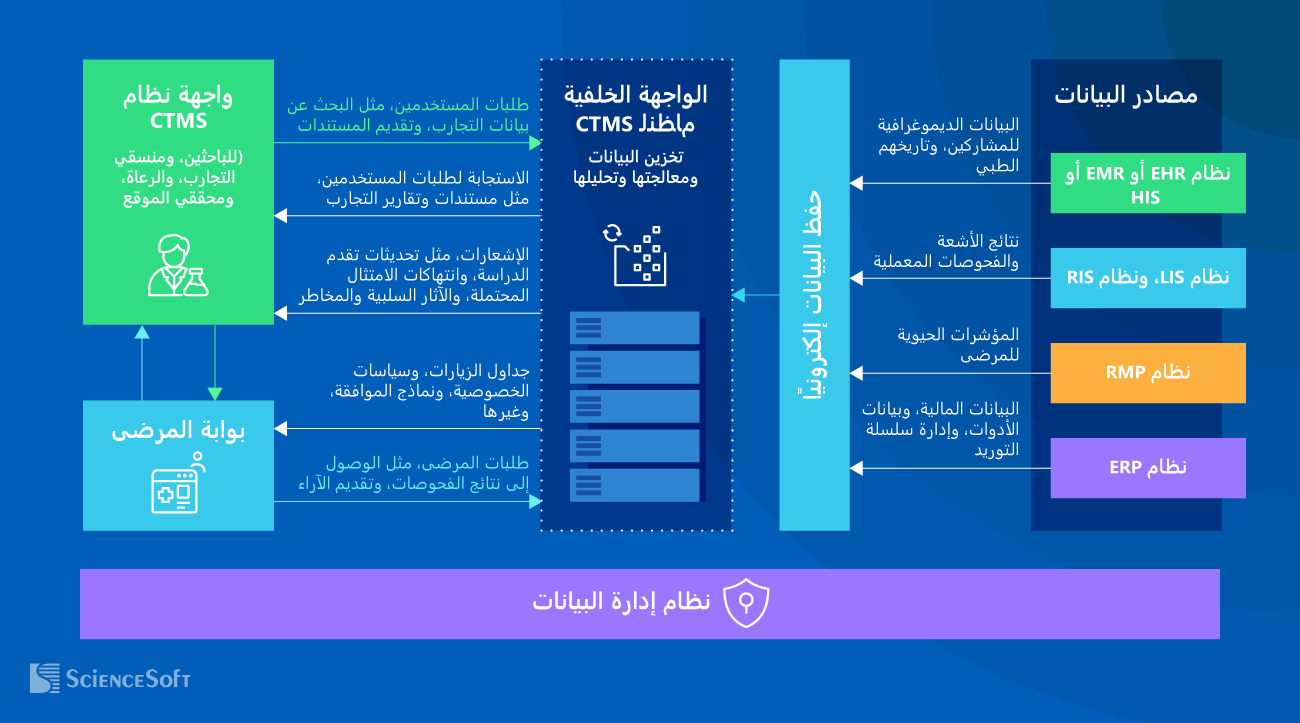
يُمكن دمج أنظمة إدارة التجارب السريرية (CTMS) مع مجموعة متنوعة من مصادر البيانات (مثل أنظمة EHR، وEMR، وLIS، وERP، وغيرها الكثير)، وذلك لتمكين الوصول الفوري إلى جميع المعلومات الضرورية، بما يشمل بيانات المرضى، وجداول عمل الكوادر الطبية، وبيانات توفر المستلزمات والمعدات، والبيانات المالية، وغيرها الكثير. كما يُستخدم نظام حفظ البيانات إلكترونيًا (EDC) عبر الاتصال بالإنترنت لتبسيط جمع بيانات التجارب السريرية وإدارتها.
تعمل الواجهة الخلفية لأنظمة CTMS على معالجة وتخزين البيانات المُجمعة بصيغة منظمة وجاهزة للتحليلات في مستودع البيانات. كما يعالج محرك التحليلات طلبات المستخدمين، ويُرسل المعلومات المطلوبة إلى واجهة المستخدم الرئيسية، بما في ذلك معلومات عرض البيانات، والتقارير المجدولة والفورية، ومخرجات الذكاء الاصطناعي.
تعمل بوابة المشاركين في التجارب السريرية على تعزيز مشاركة المرضى والاحتفاظ بهم من خلال منح المرضى إمكانية الوصول الفوري إلى المعلومات والجداول الزمنية والتحديثات المتعلقة بالدراسة.
يتضمن إطار إدارة البيانات آليات أمنية متقدمة تشمل النسخ الاحتياطي، وتشفير البيانات، والمصادقة متعددة العوامل، والوصول حسب دور المستخدم، وإخفاء هوية البيانات، وغيرها الكثير. وتهدف هذه التدابير إلى ضمان جودة البيانات، وسلامتها، وأمانها، وخصوصيتها وفقًا للوائح التنظيمية المعتمدة في دول الخليج، مثل نظام حماية البيانات الشخصية السعودي (PDPL)، وغيرها.
الميزات الأساسية لأنظمة إدارة التجارب السريرية (CTMS)
خطوات تطوير أنظمة إدارة التجارب السريرية
يتيح تطوير أنظمة إدارة التجارب السريرية لشركات الأبحاث الحصول على حلول مُصممة خِصيصًا للإدارة الفعَّالة لعملية الدراسة، والمواقع، والمشاركين، والميزانية، وغيرها الكثير. فيما يلي، يوضح خبراء ساينس سوفت الخطوات الرئيسية لتطوير أنظمة إدارة التجارب السريرية المخصصة حسب الطلب:
1.
هندسة المتطلبات
يُجري محللو الأعمال مقابلات مع الباحثين، ومنسقي التجارب السريرية، والجهات الراعية، والمعنيين الآخرين بهدف فهم سير عمل إدارة التجارب السريرية، بما في ذلك جمع البيانات، واستقطاب المرضى، وإجراءات الامتثال التنظيمي. واستنادًا إلى المعلومات المُجمعة، يُحدد خبراؤنا المتطلبات الوظيفية وغير الوظيفية للنظام، بما في ذلك الميزات، وعمليات التكامل الأساسية، ومتطلبات الأمان والامتثال لقوانين ولوائح حماية البيانات الصحية، ومتطلبات الهيئة العامة للغذاء والدواء السعودية (SFDA)، وإدارة الغذاء والدواء الأميركية (FDA)، وغيرها من اللوائح التنظيمية المعتمدة في دول الخليج.
2.
تصميم الحل
في هذه المرحلة، يختار مهندسو البرمجيات مكونات البنية التقنية، والأدوات، والتقنيات التي تدعم سير العمل المحدد أثناء تحليل الأعمال. ويشمل ذلك اختيار واجهات برمجة التطبيقات (APIs) العامة أو تطوير واجهات مخصصة لربط الحل بالأنظمة الضرورية، بالإضافة إلى تحديد آليات تكامل بيانات البحث وتوحيدها ومزامنتها في الوقت الفعلي. كما تتضمن هذه الخطوة أيضًا وضع الضوابط الأمنية وإجراءات إدارة البيانات.
3.
تصميم تجربة وواجهة المستخدم (UX/UI)
يُحدد المصممون مسارات استخدام مخصصة لكل دور، مع إنشاء واجهات مستخدم (UIs) لدعم سير عمل هذه المسارات. على سبيل المثال، سيستفيد منسقو التجارب السريرية من إنشاء لوحة معلومات تعطي الأولوية لمقاييس استقطاب المرضى، وجدولة الزيارات، وتنبيهات الامتثال، ما يسهم في تحسين عمليات مراقبة تقدم الدراسة وإدارة المشاركين.
4.
التطوير والاختبار
يساعد تنفيذ إجراءات التطوير بالتوازي مع اختبار البرمجيات على اكتشاف المشكلات المحتملة ومعالجتها مبكرًا، وتعزيز التعاون بين فِرق التطوير وضمان الجودة، بالإضافة إلى تجنب العيوب الخطيرة في بيئة الإنتاج. ومن بين أفضل الممارسات الأخرى لتحسين عمليات التطوير وخفض التكاليف: تنفيذ مسارات التكامل والنشر المستمر (CI/CD) وممارسات DevOps، بالإضافة إلى أتمتة إجراءات ضمان الجودة، واستخدام المكونات الخارجية والخدمات المصغرة الموثوقة مثل مكونات وأدوات تخزين وإدارة البيانات. استنادًا إلى خبرة ساينس سوفت، يُسهم هذا النهج في خفض تكاليف التطوير بنسبة تصل إلى 78%.
5.
الإطلاق والدعم
في هذه المرحلة، يُدمج النظام مع مصادر البيانات الضرورية، مثل أنظمة EHR، وأنظمة معلومات المختبر (LIS)، وأنظمة تخطيط موارد المؤسسات (ERP)، وغيرها؛ بالإضافة إلى مراقبة أداء الحل لتحديد أي عيوب برمجية وتنفيذ التحسينات اللازمة على الفور مثل تعزيز التوافق بين صيغ البيانات المختلفة. كما يُعد خبراؤنا وثائق برمجية شاملة للحل (مثل أدلة التهيئة والصيانة، وتعليمات استخدام واجهة برمجة التطبيقات) لتسهيل إطلاق الحل وصيانته وتحسينه في المستقبل. في ساينس سوفت، نقدم ضمانًا لمدة شهر واحد بعد إطلاق الحل، حيث نتولى إصلاح أي مشكلات رئيسية في البرمجيات مجانًا.
التقنيات التي نستخدمها
لغات برمجة الواجهة الخلفية
لغات برمجة الواجهة الأمامية
برامج الواجهة الامامية (Front end)
أُطر عمل JAVASCRIPT
الجوال
المنصات السحابية
قواعد البيانات والمستودعات ومخازن البيانات السحابية
AWS





Azure
Google Cloud Platform
جوائزنا وشراكاتنا
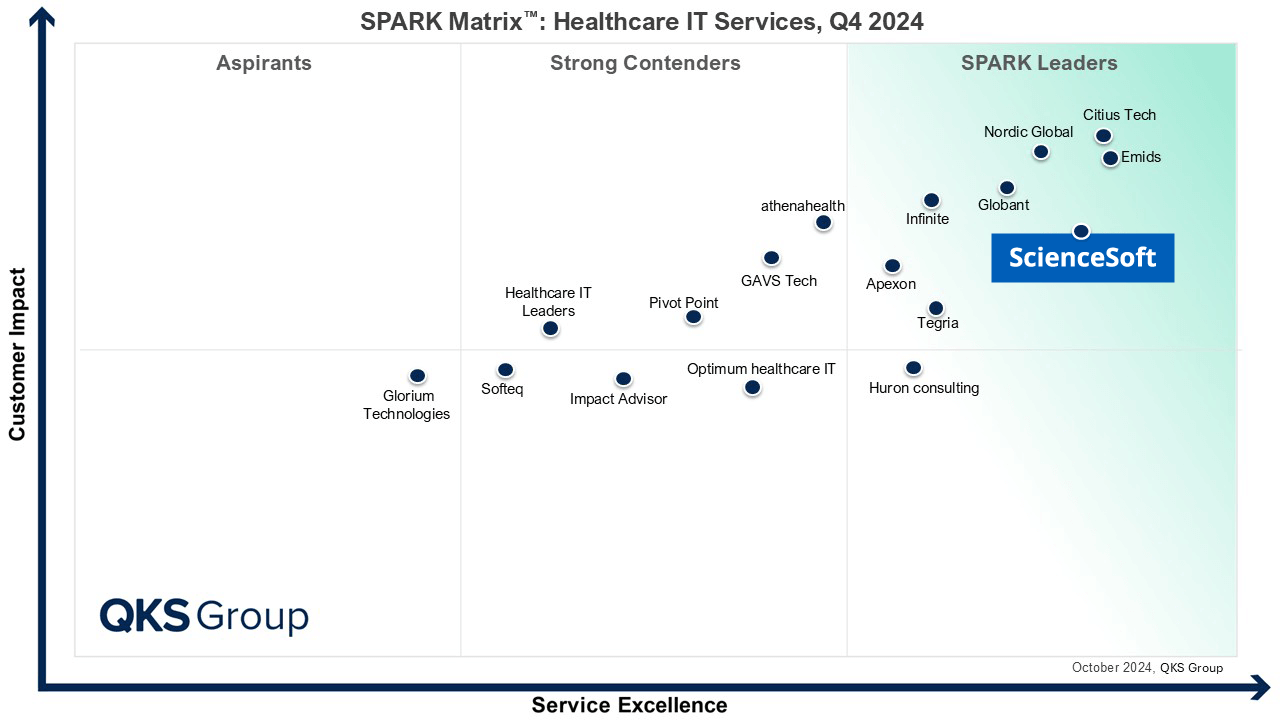
مصنفون ضمن الشركات الرائدة في سوق خدمات تقنية معلومات الرعاية الصحية حسب تقرير SPARK Matrix لعامي 2022 و2024
حاصلون على جوائز فروست آند سوليفان (Frost & Sullivan) تكريمًا لريادتنا في مجال تقنية معلومات الرعاية الصحية لعامي 2023 و2025.
مصنفون ضمن أفضل شركات تطوير برمجيات الرعاية الصحية في الإمارات
شريك مايكروسوفت منذ عام 2008
شريك أمازون (AWS) منذ عام 2017
مدرجون ضمن قائمة IAOP لأفضل 100 شركة عالمية لخدمات التعاقد الخارجي في 2025، وذلك للعام الرابع على التوالي
نظام إدارة جودة معتمد بشهادة ISO 9001
نظام إدارة أمن المعلومات معتمد بشهادة ISO 27001
تكاليف أنظمة إدارة التجارب السريرية
تبدأ تكلفة تطوير أنظمة إدارة التجارب السريرية من 187,000 ريال سعودي، وقد تصل إلى أكثر من 1.8 مليون ريال سعودي، حسب تعقيد الحل. يمكن أن تُحقق أنظمة CTMS المخصصة عائدًا على الاستثمار (ROI) يصل إلى 270% خلال 4 أعوام. وتعد ميزات الأتمتة (مثل حفظ البيانات، واستقطاب المرضى) من أبرز عوامل تحقيق العائد، حيث تسهم في تسريع إتمام التجارب، وتقليل الأخطاء، وخفض التكاليف الإدارية. عند تحديد تكلفة أنظمة CTMS المخصصة، تأخذ ساينس سوفت في الحسبان عوامل مثل عدد عمليات التكامل وتعقيدها، ونطاق سير عمل إدارة التجارب، ومدى الحاجة إلى معالجة البيانات في الوقت الفعلي، والميزات المدعومة بتقنيات تعلم الآلة (ML) والذكاء الاصطناعي (AI)، وغيرها من العوامل.
187,000 – 560,000 ريال سعودي
لتطوير حل بسيط بالإمكانات الآتية:
- ميزات أساسية مثل أتمتة حفظ البيانات إلكترونيًا، وتتبع تسجيل المرضى، وتخطيط الدراسات ومراقبة تقدمها، وإدارة المواقع والموارد، وغيرها.
- التكامل مع ما يصل إلى 3 أنظمة، مثل EMR، وERP، وأنظمة الباركود.
- إمكانات تحليلية أساسية، مثل تقديم رؤى تاريخية عن البيانات الديموغرافية للمرضى، ومعدلات الانسحاب من المشاركة.
560,000 – أكثر من 1.8 مليون ريال سعودي
حل متقدم بالإمكانات الآتية:
- ميزات متقدمة مثل مراقبة المخاطر في الوقت الفعلي، والدفع المدمج داخل النظام.
- التكامل مع جميع مصادر البيانات المطلوبة، بما في ذلك الأنظمة القديمة والمخصصة.
- إمكانات تحليلية متقدمة، بما في ذلك ميزات مدعومة بخوارزميات تعلم الآلة (ML) والذكاء الاصطناعي (AI) للتنبؤ بالأحداث السلبية، وتقديم توصيات عملية لتحسين تخصيص الموارد، وغير ذلك.
احصل على عرض أسعار مخصص لمشروع نظام إدارة التجارب السريرية
ما عليكم سوى الإجابة عن بعض الأسئلة البسيطة حول احتياجاتكم، وسيرسل إليكم خبراؤنا تقديرًا مخصصًا لتكلفة مشروعكم.
مقارنة بين البرمجيات الجاهزة والمصممة حسب الطلب لإدارة التجارب السريرية (CTMS)
هناك العديد من أنظمة إدارة التجارب السريرية الجاهزة في السوق تتنوع من حيث النطاق الوظيفي، والتعقيد، وعمليات التكامل، والتكلفة؛ لكن لا تلبي أي منها جميع الاحتياجات الفريدة لمؤسسات الرعاية الصحية. لذا؛ يُنصح باختيار الأداة المفضلة بناءً على الاحتياجات المحددة لكل مؤسسة. في بعض الحالات، يكون التطوير المُخصص أكثر جدوى، إذ لا تقدم الحلول الجاهزة سعة تخزين ومعالجة كافية للتجارب التي تعتمد بشكل أساسي على البيانات، مثل الأبحاث الجينومية، وتتبع اتجاهات البيانات الطولية.
تُعد الحلول المخصصة خيارًا مثاليًا للمؤسسات التي تُجري تجارب متعددة على مدى فترات زمنية طويلة، حيث تستفيد هذه المؤسسات من تجنب رسوم الاشتراك في البرمجيات، ما يسهم في خفض ملحوظ للتكاليف على المدى الطويل.
فيما يلي، يقدم لكم خبراؤنا مقارنة بين ميزات وتكاليف البرمجيات الشائعة المتاحة في السوق، والحلول المُصممة خصيصًا حسب الطلب.
|
|
Clinevo |
SimpleTrials |
Medidata |
الأنظمة المخصصة |
|---|---|---|---|---|
|
الميزات الأساسية لإدارة التجارب السريرية
?
أتمتة حفظ البيانات إلكترونيًا، وتتبع تسجيل المرضى، وتخطيط الدراسات ومراقبة تقدمها، وإدارة الموقع والموارد |
|
|
|
|
|
ميزات مخصصة لتخصصات طبية وأنواع تجارب محددة (مثل طب الأورام، وأمراض القلب).
|
|
|
|
جميع الميزات المطلوبة لتخصصات محددة (مثل قوالب جاهزة لإنشاء بروتوكولات مخصصة لأمراض محددة، وأدوات الإبلاغ عن الأحداث السلبية). |
|
ميزات مدعومة بالذكاء الاصطناعي
|
|
|
ميزات الذكاء الاصطناعي (مثل تحديد الأنماط، والتنبؤ بالمخاطر) عند الاشتراك في منتج Medidata المخصص. |
إمكانات الذكاء الاصطناعي أو تعلم الآلة من أي تعقيد، بما في ذلك المساعدين الافتراضيين، وتحليل الصور الطبية، والتحليلات التنبؤية، والمزيد. |
|
النظام الأساسي للتشغيل
|
الويب، وiOS، وأندرويد |
الويب |
الويب |
جميع أنظمة التشغيل (الويب، وiOS، وأندرويد) |
|
السهولة في الاستخدام
?
بناء على تقييم خبراء ساينس سوفت .تتضمن المعايير الرئيسية: سهولة وتخصيص تجربة وواجهة المستخدم، وسرعة اعتماد الحل. |
|
|
|
|
|
عمليات التكامل
|
التكامل الأصلي مع نظام Clinevo eTMF وأنظمة إدارة التدريب. |
التكامل الأصلي مع 8 من أنظمة حفظ البيانات إلكترونيًا (EDC)، مثل Castor، وClinCapture، وIBM CD، وغيرها. |
التكامل الأصلي مع نظام Medidata EDC، وأنظمة الدفع في المواقع. تكامل واجهة برمجة التطبيقات (API) مع الأنظمة الخارجية، مثل أنظمة حفظ البيانات إلكترونيًا (EDC)، وأنظمة إدارة التجارب السريرية (CTMS) الأخرى، وأنظمة الملف الرئيسي للتجربة السريرية (eTMF)، وأنظمة الاستجابة التفاعلية عبر الويب (IxWR)، بالإضافة إلى أنظمة التخطيط الخارجية. |
التكامل بسلاسة مع جميع الحلول المخصصة والجاهزة، بما في ذلك البرمجيات القديمة. |
|
الامتثال
|
الامتثال لمتطلبات القسم 11 من اللائحة 21 CFR الصادرة عن إدارة الغذاء والدواء الأميركية (FDA)، والملحق 11 من ممارسات التصنيع الجيدة الأوروبية (EU GMP)، والممارسات الجيدة في التصنيع (GxP)، واللائحة العامة لحماية البيانات (GDPR). |
الامتثال لمتطلبات القسم 11 من اللائحة 21 CFR الصادرة عن إدارة الغذاء والدواء الأميركية (FDA)، ومعيار SOC 2 للتحكم في أمن البيانات، ومعيار أمان بيانات بطاقات الدفع (PCI DSS). |
الامتثال لقانون HIPAA، ولائحة GDPR، ومتطلبات FDA، وهيئة الغذاء والدواء الصينية (CFDA)، وهيئة تنظيم الأدوية ومنتجات الرعاية الصحية في المملكة المتحدة (MHRA)، والوكالة اليابانية للأدوية والأجهزة الطبية (PMDA)، ومعيار SOC 2، ومعيار PCI DSS. |
الامتثال لجميع اللوائح العالمية والإقليمية المعتمدة في دول الخليج. |
|
التسعير (50 حساب مستخدم / 10 أعوام)
|
متاح عند الطلب. |
من 1.8 إلى 2.2 ريال سعودي لخطة تغطي ما يصل إلى 100 دراسة سريرية، مع ميزات أساسية ومتقدمة مثل إدارة الموقع والمستندات، والدفع داخل النظام، والتنبؤ. NB: There are more affordable options (e.g., up to ~$115,000) with core capabilities and a limited number of users (up to 10). |
متاح عند الطلب. |
يصل إلى أكثر من 1.8 مليون ريال سعودي. لعدد غير محدود من المستخدمين والدراسات. ولا توجد رسوم إضافية. |