أنظمة إدارة البيانات السريرية (CDM)
الميزات، وخطوات التطوير، والتكاليف
بخبرتنا الممتدة في مجال تقنية معلومات الرعاية الصحية منذ عام 2005، نصمم في ساينس سوفت حلولًا متوافقة مع المعايير واللوائح لإدارة التجارب السريرية، تعمل على أتمتة مسارات العمل الفريدة لإدارة البيانات، وتقديم تحليلات متقدمة، إلى جانب التكامل بسلاسة مع الأنظمة الداخلية وبرمجيات الموردين الخارجيين، بما في ذلك المختبرات ومقدمي خدمات التصوير الطبي.
لمحة سريعة عن أنظمة إدارة البيانات السريرية (CDM)
تُستخدم أنظمة إدارة البيانات السريرية (CDM) في مجال البحث والتطوير في علوم الحياة لتوحيد بيانات التجارب المُجمعة، وتنقيتها من الأخطاء والتناقضات، وتحويلها إلى مجموعات بيانات بحثية جاهزة للتحليل الإحصائي. في بعض الأحيان، تتضمن أنظمة إدارة البيانات السريرية وحدة برمجية لجمع البيانات إلكترونيًا (EDC) تهدف إلى تجميع بيانات ملاحظة المرضى مثل نتائج العلاج التي يقدمها المرضى أو الأطباء من نماذج التقييم الإلكتروني للنتائج السريرية (eCOA)، والنماذج الإلكترونية لتسجيل بيانات الحالة (eCRFs)، وبيانات الزيارات الطبية، ونتائج المختبر والصور الطبية، وقراءات أجهزة الاستشعار والأجهزة القابلة للارتداء، وغير ذلك. ومع ذلك، في معظم المؤسسات البحثية، تعد أنظمة إدارة البيانات السريرية (CDM) وأنظمة جمع البيانات إلكترونيًا (EDC) نوعين منفصلين من الأنظمة.
يتزايد الطلب على برمجيات إدارة البيانات السريرية (CDM) المتقدمة مع حاجة البحوث إلى أدلة أكثر ثراءً، وتكامل المزيد من مصادر البيانات. في دراسة استقصائية حديثة، صرَّح 93% من 149 جهة راعية بأن عمليات مراجعة البيانات السريرية وتكاملها وتحليلها لا تزال تعتمد على الجهود اليدوية، وتستغرق وقتًا طويلًا، وتتطلب تدخلًا بشريًا بشكل مكثف.
يُعد تطوير أنظمة CDM المخصصة خيارًا مثاليًا لمؤسسات البحث وشركات الأدوية في الحالات التالية:
- الحاجة إلى استيراد البيانات من مصادر خارجية متعددة مثل المختبرات المتخصصة أو خدمات الأشعة.
- صعوبة أو تعذّر دمج حلول CDM الجاهزة مع البرمجيات المخصصة المستخدمة، خاصة الأنظمة القديمة مثل أنظمة جمع البيانات إلكترونيًا (EDC).
- حاجة مؤسسات البحث إلى إمكانات تحليلية فريدة لتسريع البحث، واستخلاص الرؤى حول جودة البيانات، ومعالجة المخاطر الحرجة المرتبطة بها.
المدة الزمنية للتنفيذ: من 6 أشهر إلى أكثر من 24 شهرًا.
التكاملات الأساسية لأنظمة إدارة البيانات السريرية (CDM): مع أنظمة جمع البيانات إلكترونيًا (EDC)، ومستودعات البيانات السريرية (CDR) أو مخازن البيانات، وأنظمة بيئة الحوسبة الإحصائية (SCE)، وبرمجيات المختبرات الخارجية أو مقدمي خدمات التصوير الطبي.
التكاليف: من 450,000 ريال سعودي إلى 3,3 ملايين ريال سعودي، حسب تعقيد الحل. يُمكنكم استخدام أداتنا المجانية للحصول على تقدير تكلفة مخصص لمشروعكم.
الميزات الأساسية لأنظمة إدارة البيانات السريرية (CDM)
تهدف حلول إدارة البيانات السريرية في الأساس إلى تسريع دورة البحث العلمي من خلال الأتمتة ورفع كفاءة الموظفين، إلى جانب الاستفادة من التحليلات المتقدمة، بما في ذلك تحليل البيانات بالذكاء الاصطناعي (AI). فيما يلي لمحة عامة على الميزات الأساسية لأنظمة إدارة البيانات السريرية (CDM) التي تلبي معظم احتياجات عملاء ساينس سوفت في مجال البحث والتطوير في علوم الحياة. مع ذلك، يتمتع كل حل بمجموعة ميزات فريدة، بناءً على متطلبات وأولويات كل مؤسسة بحثية.
جمع وتوحيد البيانات الأوَّلية
- جمع بيانات التجارب من مصادر متنوعة، بما في ذلك أنظمة جمع البيانات إلكترونيًا (EDC)، ومقدمو خدمات المختبر والتصوير الطبي، وغير ذلك.
- إخفاء هوية البيانات.
- الفحص التلقائي للبيانات الواردة لاكتشاف القيم غير الصالحة أو المفقودة أو خارج النطاق، وكذلك التناقضات بين المصادر المختلفة.
- إتاحة خيار المعالجة اليدوية للمشكلات مع البيانات الواردة لحل مشكلات استيراد البيانات التي أشارت إليها الخوارزميات الآلية.
- التوحيد التلقائي للبيانات الواردة، مثل توحيد وحدات القياس وصيغ التاريخ.
- الترميز الآلي لمصطلحات الحالات المرضية وأسماء الأدوية باستخدام قواميس شائعة مثل MedDRA، WHODrug.
- التحميل التلقائي للبيانات المُعالجة إلى مستودعات البيانات السريرية.
أدوات تنظيف البيانات
- مكتبة للقواعد المهيأة مسبقًا للتحقق من البيانات.
- أداة لإنشاء قواعد مخصصة للتحقق من البيانات دون الحاجة إلى البرمجة.
- الكشف عن الأخطاء والتناقضات والانحرافات في سجلات المرضى باستخدام تقنيات تعلم الآلة (ML) والذكاء الاصطناعي، مثل:
- الأخطاء والتناقضات، بما في ذلك الجرعات الخاطئة وتضارب الأدوية المرافقة عبر زيارات المستشفى المختلفة.
- التغيرات غير الطبيعية في حالة المرضى، مثل التحولات المفاجئة في نتائج المختبر بين الزيارات.
- الملفات التعريفية للمرضى التي تحتوي على توزيعات بيانات تختلف عن المجموعة الإجمالية.
- التناقضات في القوائم مثل الأحداث السلبية، والتاريخ الطبي، ومجموعات بيانات الأدوية المرافقة.
مراجعة بيانات التجارب
- واجهة موحدة لمديري البيانات مع تمكين الوصول إلى القوائم، والملفات التعريفية والبيانات المصدرية للمرضى، وتقارير الحالات غير النمطية، وأدوات تتبع الاستعلامات.
- مراجعة البيانات السريرية والتعليق عليها بشكل تعاوني.
- متتبع تغييرات تلقائي يشير إلى البيانات الجديدة أو المعدلة لمراجعتها من قبل الجهات المختصة.
- مسارات عمل آلية للموافقة من خلال إرسال البيانات لمراجعتها بناءً على أدوار المستخدم.
- إعداد تقارير قابلة للتخصيص لتسليط الضوء على المشكلات النشطة، والاستعلامات، والتغييرات التي طرأت منذ آخر مراجعة.
- قفل البيانات تلقائيًا بعد إتمام عملية المراجعة.
إدارة الاستعلامات
- إنشاء استعلامات نظام جمع البيانات إلكترونيًا (EDC) وإسنادها إلى أفراد أو أدوار مستخدم محددة لحلها.
- إرسال الاستعلامات مباشرةً من نظام CDM إلى الشركاء الخارجيين، مثل المختبرات، عبر البريد الإلكتروني.
- أتمتة إنشاء الاستعلامات وتحديد أولوياتها وإغلاقها، بما في ذلك المشكلات المُعلقة منذ فترة طويلة.
- تتبع الاستعلامات حسب الأولوية، والمريض، والمسؤول عن حلها، وتاريخ الاستحقاق، والموقع، ونطاق البيانات، وغير ذلك.
- سير عمل آلي للموافقة على الاستعلامات وتصعيدها وحلها.
تتبع المرضى ذوي البيانات المُنقحة
- ملفات تعريف للمرضى تضم جميع بيانات الملاحظة المجمعة لكل مريض، بما في ذلك بيانات النماذج الإلكترونية لتسجيل بيانات الحالة (eCRFs)، ونماذج التقييم الإلكتروني للنتائج السريرية (eCOA)، ومخرجات الأجهزة القابلة للارتداء، ونتائج المختبر، والأشعة السينية، وغير ذلك.
- لوحات معلومات تعرض بيانات مرئية عن حالة المرضى والعلاج.
- الوصول إلى سجلات المرضى المخزنة في أنظمة جمع البيانات إلكترونيًا (EDC) أو أي نظام مدمج آخر مباشرةً من أداة تتبع المرضى.
- تتبع التقدم في تنظيف البيانات وحالة جاهزيتها.
التحليلات وإعداد التقارير
- التتبع الفوري للتقدم في معالجة البيانات وحالة جاهزيتها على مستوى المرضى الأفراد، ومجموعات المرضى، والدول، والمواقع.
- إعداد تقارير مجدولة وحسب الطلب، بما في ذلك تقارير جودة البيانات، وتقارير حالة الترميز.
- مكتبة لقوالب التقارير.
أداة لإنشاء القوائم دون كود أو بالحد الأدنى من البرمجة
- أداة لإنشاء التعبيرات بطريقة السحب والإفلات لإنشاء وتعديل القوائم ومجموعات البيانات المنسقة الأخرى.
- قوالب جاهزة للقوائم، مع إمكانية إعادة استخدام القوائم المخصصة كقوالب.
- وظائف جاهزة لحساب القيم المشتقة (مثل مؤشرات احتمالية حدوث مضاعفات)، مع إمكانية إنشاء وظائف مخصصة وحفظها.
تصدير البيانات
- تصدير حزم البيانات المنقّحة بتنسيق محدد سابقًا، سواء عند الطلب أو وفق جدول زمني آلي.
- تصدير البيانات بكميات كبيرة.
- دعم صيغ مختلفة، مثل CSV، وPDF، وغيرها.
- حفظ البيانات بصيغ متوافقة مع برمجيات التحليل الإحصائي SAS أو SPSS.
- تبادل البيانات وفقًا لمعايير HL7 وFHIR وDICOM؛ مع الالتزام بمعايير تبادل البيانات CDISC.
إدارة الجودة القائمة على المخاطر (RBQM)
- إعداد مؤشرات المخاطر الرئيسية (KRIs) وحدود التسامح مع الجودة (QTLs) لأداء المواقع وجودة التجارب.
- لوحات معلومات تتيح مراقبة مؤشرات الأداء والمخاطر على مستوى الموقع، والدولة، والدراسة.
- تحليل المخاطر بالذكاء الاصطناعي (AI) لتحديد المشكلات المحتملة المتعلقة بأداء الموقع أو الامتثال أو جودة البيانات.
الامتثال والأمان وخصوصية البيانات
- التحكم في الوصول حسب الأدوار، بما في ذلك مصادقة المستخدم، وإدارة صلاحيات الوصول، وأذونات الإجراءات، وتسجيل الخروج التلقائي، وغير ذلك.
- الوصول التفصيلي للبيانات (مثلًا: للتقارير الفردية أو الحقول المحددة).
- المصادقة متعددة العوامل (MFA).
- التشفير الشامل للبيانات أثناء تخزينها ونقلها.
- سجلات تدقيق لجميع إجراءات المستخدم والنظام، مع تفصيل التغييرات المُنفَّذة، والأطراف المسؤولة، والطوابع الزمنية.
- الامتثال لمتطلبات الهيئة العامة للغذاء والدواء السعودية (SFDA) المتعلقة بإرشادات الجودة السريرية (GCP-SFDA)، ونظام حماية البيانات الشخصية (PDPL)، ومتطلبات الأمن السيبراني الوطنية بشأن السجلات الإلكترونية والتوقيعات، بالإضافة إلى معايير الأيزو 14155:2020 للتجارب السريرية؛ وغيرها من اللوائح المعمول بها في دول الخليج.
التكاملات المُمكنة لأنظمة إدارة البيانات السريرية
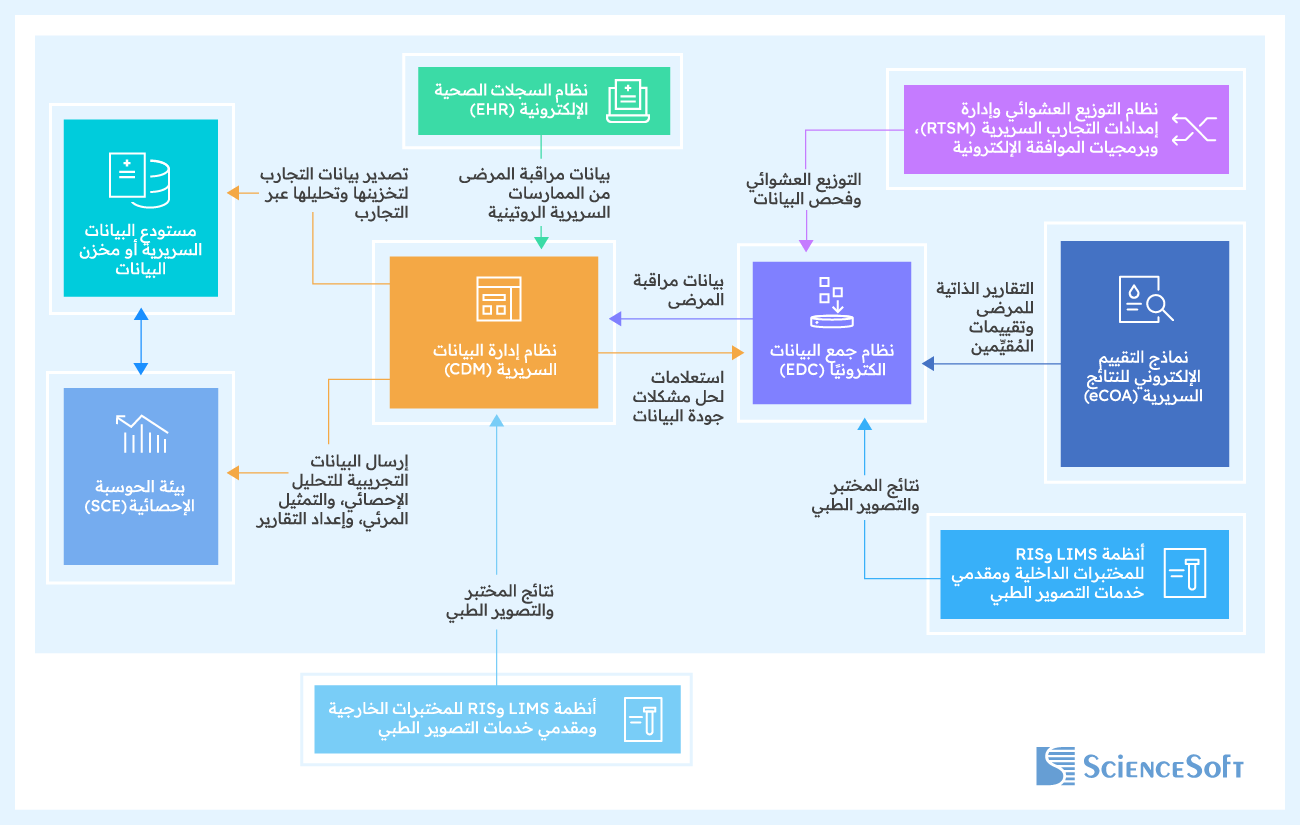
أنظمة جمع البيانات إلكترونيًا (EDC): لنقل البيانات تلقائيًا من النماذج الإلكترونية لتسجيل بيانات الحالة (eCRFs) إلى ملفات تعريف المرضى في أنظمة إدارة البيانات السريرية (CDM)؛ ولإرسال استعلامات توضيح البيانات إلى موظفي المواقع، وتلقي ردودهم.
المختبرات الخارجية وخدمات التصوير الطبي: لأتمتة استيراد التقارير التي تتضمن نتائج فحوصات المرضى.
مستودعات البيانات السريرية (CDR) أو مخازن البيانات (DWH): لتصدير بيانات التجارب إلى المستودع المركزي للتخزين، ولمراجعة الجهات الراعية أو مؤسسات البحوث التعاقدية (CRO)، ولإتاحتها لفرق بحثية أخرى.
أنظمة بيئات الحوسبة الإحصائية (SCE): لإرسال بيانات التجارب المُنقحة لإجراء المزيد من التحليلات الإحصائية والتمثيل المرئي وإعداد التقارير الموجهة للهيئات التنظيمية الصحية.
الخطوات الأساسية لتطوير نظام إدارة البيانات السريرية
فيما يلي، يستعرض خبراء ساينس سوفت الخطوات الأساسية لتطوير أنظم إدارة البيانات السريرية (CDM).
هندسة المتطلبات
يُجري المستشارون ومحللو الأعمال مقابلات مع الجهات المعنية في المؤسسة البحثية، بما في ذلك المستخدمون المستهدفون للحل (مثل مديري بيانات التجارب، والمراجعين الطبيين، وموظفي المواقع) لتحديد متطلبات توحيد البيانات وتنظيفها وتحليلها، بالإضافة إلى الإمكانات الأخرى لبرمجيات إدارة البيانات السريرية.
في هذه المرحلة، من الضروري تحديد العدد المتوقع لمصادر البيانات، وصيغ البيانات الواردة من الموردين الخارجيين (مثل مختبرات المؤشرات الحيوية أو المختبرات التخصصية)، إلى جانب تحديد الأنظمة المطلوب دمجها مع نظام إدارة البيانات السريرية. استنادًا إلى هذه المعلومات، يتم إعداد وثيقة مواصفات متطلبات البرمجيات (SRS)، التي تتضمن الإمكانات الوظيفية وقدرات الأداء، بالإضافة إلى ميزات الأمان والامتثال.
عادةً ما تستند متطلبات الامتثال الخاصة بالبرمجيات إلى معايير الهيئة العامة للغذاء والدواء السعودية (SFDA) المتعلقة بإرشادات الجودة السريرية (GCP-SFDA)، ونظام حماية البيانات الشخصية (PDPL)، ومتطلبات الأمن السيبراني الوطنية بشأن السجلات الإلكترونية والتوقيعات، بالإضافة إلى معايير الأيزو 14155:2020 للتجارب السريرية؛ وغيرها من المعايير واللوائح المعمول بها في دول الخليج.
تصميم البرمجيات
في هذه المرحلة، يُحدد مهندسو البرمجيات مكونات البنية التقنية لنظام CDM، وأساليب التكامل المُثلى، والأدوات والتقنيات اللازمة لتطوير الحل. كما تشمل هذه المرحلة تحديد طرق تكامل البيانات السريرية، وتوحيد صيغها، ومزامنتها في الوقت الفعلي، وتتبع تغييراتها، إضافةً إلى إدارة النسخ الاحتياطية وعمليات تصدير البيانات. وبالتعاون مع خبراء الامتثال، يصمم مهندسو البرمجيات أيضًا التدابير الأمنية اللازمة لحماية النظام من التهديدات الإلكترونية.
تصميم تجربة وواجهة المستخدم (UX/UI)
يتولى مصممو تجربة وواجهة المستخدم (UX/UI) تخطيط مسارات العمل، وإنشاء واجهات مصممة خِصيصًا لتلبية احتياجات أدوار المستخدم المحددة. على سبيل المثال، قد يحتاج مديرو البيانات إلى أداة سلسة لتتبع حالة المرضى، تتيح تمثيلًا بيانيًا غنيًا للبيانات، والوصول إلى المهام غير المُنجَزة لكل موقع، أو مريض، أو مجموعة مرضى.
بالإضافة إلى ذلك، يخطط المصممون لوحات معلومات وواجهات ملائمة لكل دور مستخدم، بحيث تكون الأدوات الأساسية متاحة بسهولة، مع الاحتفاظ بالأدوات الثانوية جانبًا لتقليل الفوضى في واجهة المستخدم وتسهيل التنقل.
التطوير وضمان الجودة
في هذه الخطوة، يُطوِّر خبراؤنا الواجهة الخلفية والأمامية لنظام CDM وفقًا لمواصفات متطلبات البرمجيات، وتخطيطات وتصميمات تجربة وواجهة المستخدم (UX/UI). عادةً ما تُطوَّر الميزات في مراحل تطويرية متكررة، وبعد كل إصدار، تُعرض الوظائف المنجزة للمستخدمين المستهدفين لتجربتها وتقديم ملاحظاتهم وتعليقاتهم التي تساعد على تحسين الحل في الإصدارات المستقبلية. على سبيل المثال، سيحتاج المطورون إلى آراء المراجعين الطبيين حول كيفية تحسين نظام التعرف الآلي على مشكلات البيانات وإنشاء الاستعلامات.
عادةً ما يتضمن كل تكرار اختبار الوظائف الجديدة والحالية. بالنسبة إلى أنظمة إدارة البيانات السريرية، يُعد اختبار التكامل بالغ الأهمية لضمان سلامة بيانات التجارب عند نقلها إلى مستودعات البيانات وأنظمة جمع البيانات إلكترونيًا (EDC) رغم التحديثات المستمرة من قبل عدة مستخدمين. أما اختبارات الأمان، فيتم تنفيذها قبل الإصدارات الرئيسية وإطلاق النظام، وذلك لضمان امتثال النظام لمتطلبات خصوصية البيانات وسلامتها.
الإطلاق والدعم
بعد إطلاق النظام، يدعم فريق التطوير فريق الأبحاث في اعتماد نظام إدارة البيانات السريرية (CDM) الجديد من خلال توفير أدلة مستخدم شاملة وتقديم الاستشارات لتسريع تبنّي الحل. أما في المشروعات واسعة النطاق، فيتم إنشاء مركز دعم فني لمعالجة طلبات المستخدمين وحل المشكلات بسرعة. كما يقدم خبراؤنا دعمًا مستمرًا للنظام، مع متابعة أدائه وإجراء التعديلات اللازمة عند الحاجة.
كم تكلفة تطوير نظام مخصص لإدارة البيانات السريرية؟
استنادًا إلى خبرة ساينس سوفت في تطوير برمجيات الرعاية الصحية، تتراوح تكاليف إنشاء نظام إدارة البيانات السريرية (CDM) من 450,000 ريال سعودي إلى 3,3 ملايين ريال سعودي. وتعتمد التكاليف في المقام الأول على عدد مصادر البيانات، والحاجة إلى الأتمتة المدعومة بالذكاء الاصطناعي، بما في ذلك اكتشاف مشكلات البيانات، وتمثيلها بصريًا، وتحليلها.
في الجدول التالي، نقدم لمحة عامة عن الميزات النموذجية الموجودة في حلول CDM الأساسية والقياسية والمتقدمة، مع توضيح التكاليف التقديرية لتنفيذها.
أساسي
إمكانات أساسية:
- استيراد البيانات من نظام جمع البيانات إلكترونيًا (EDC).
- عرض بيانات المرضى المُجمعة.
- تتبع الاستعلامات.
- تتبع التغييرات.
- سير عمل آلي لإسناد مهام المراجعة حسب دور المستخدم.
بدءًا من 450,000 ريال سعودي
قياسي
بالإضافة إلى إمكانات النظام الأساسي، تضم الحلول القياسية الميزات التالية:
- أتمتة إدارة بيانات التجارب السريرية.
- أتمتة إدارة الاستعلامات.
- تصدير البيانات تلقائيًا إلى مستودعات البيانات السريرية أو مخازن البيانات (DWH)، وبيئات الحوسبة الإحصائية.
بدءًا من 1.12 مليون ريال سعودي
متقدم
بالإضافة إلى إمكانات النظام القياسي، تضم الحلول المتقدمة الميزات التالية:
- استيراد البيانات مباشرةً من أنظمة الشركاء، بما في ذلك أنظمة السجلات الصحية الإلكترونية (EHR)، وأنظمة معلومات المختبر (LIMS)، وأنظمة معلومات الأشعة (RIS).
بدءًا من 3,3 ملايين ريال سعودي
اطلب تقدير تكلفة تطوير نظام إدارة البيانات السريرية (CDM)
خبراء ساينس سوفت على استعداد لتقديم عرض أسعار مخصص لمشروعكم.
لماذا تختارون التعاون مع ساينس سوفت لتطوير أنظمة إدارة البيانات السريرية (CDM)؟
- خبرة منذ عام 2005 في مجال تقنية معلومات الرعاية الصحية؛ مع إنجاز أكثر من 150 مشروعًا ناجحًا في هذا المجال.
- خبرة واسعة في تلبية متطلبات الهيئة العامة للغذاء والدواء السعودية (SFDA) المتعلقة بإرشادات الجودة السريرية (GCP-SFDA)، ونظام حماية البيانات الشخصية (PDPL)، ومتطلبات الأمن السيبراني الوطنية بشأن السجلات الإلكترونية والتوقيعات، بالإضافة إلى معايير الأيزو 14155:2020 للتجارب السريرية، وغيرها من المعايير واللوائح المعمول بها في دول الخليج.
- خبرة عملية في تطبيق معايير تبادل بيانات الرعاية الصحية مثل HL7، وFHIR، وDICOM، وغيرها الكثير.
جوائزنا وشراكاتنا
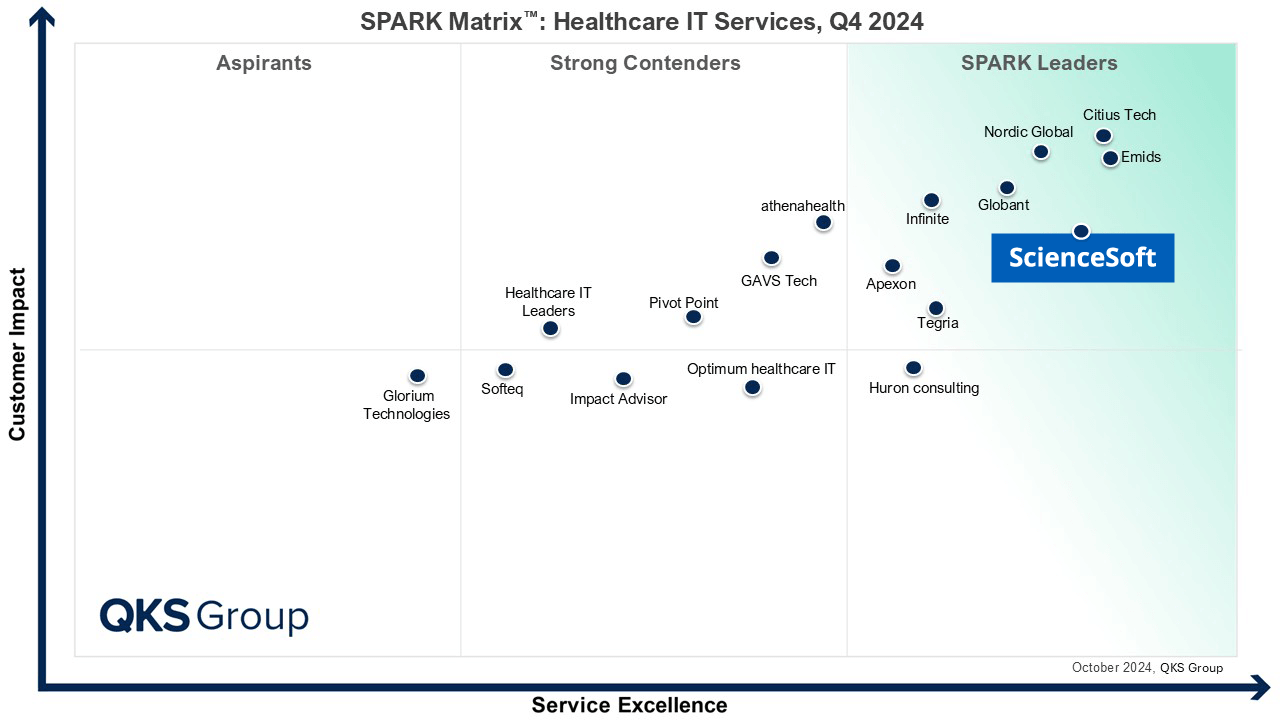
مصنفون ضمن الشركات الرائدة في سوق خدمات تقنية معلومات الرعاية الصحية حسب تقرير SPARK Matrix لعامي 2022 و2024
حاصلون على جوائز فروست آند سوليفان (Frost & Sullivan) تكريمًا لريادتنا في مجال تقنية معلومات الرعاية الصحية لعامي 2023 و2025.
مصنفون ضمن أفضل شركات تطوير برمجيات الرعاية الصحية في الإمارات
شريك مايكروسوفت منذ عام 2008
شريك أمازون (AWS) منذ عام 2017
مدرجون ضمن قائمة IAOP لأفضل 100 شركة عالمية لخدمات التعاقد الخارجي في 2025، وذلك للعام الرابع على التوالي
نظام إدارة جودة معتمد بشهادة ISO 9001
نظام إدارة أمن المعلومات معتمد بشهادة ISO 27001


